


【原创】你必须关注《疫苗生产流通管理规定》的以下几个方面要求
发布时间:2022-07-15 09:13:31作者:武汉医药行业协会浏览次数:907
////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////
原创 Julia 中国医药商业协会医药供应链分会 2022-07-13 09:57 发表于上海
医药云视界
PHARMACEUTICAL HORIZON
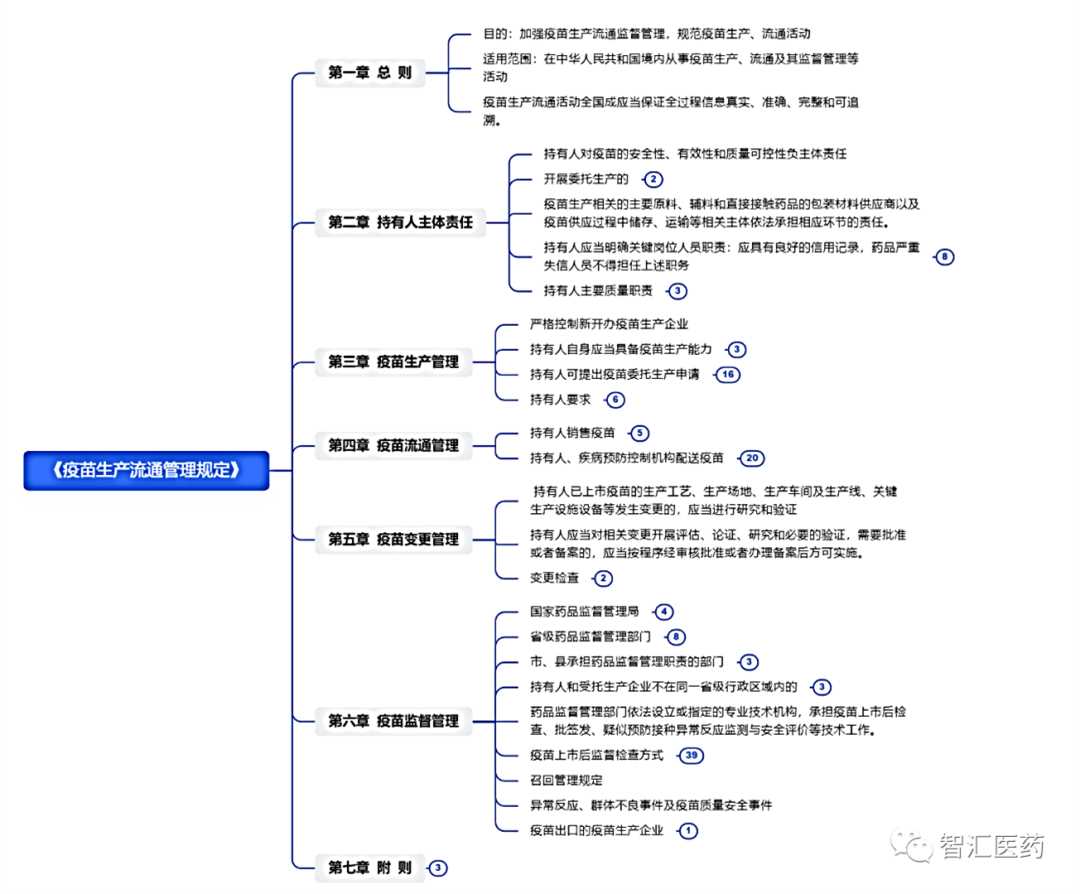
7月8日消息,国家药监局网站发布《疫苗生产流通管理规定》(以下简称《规定》),并明确自发布之日起施行。该《规定》分别2020年5月和2021年3月1日两次公开征求意见,时至今年7月8日正式发布实行。在中华人民共和国境内从事疫苗生产、流通及其监督管理等活动适用本《规定》。
《规定》主要管要求提炼如下:
一、国家对疫苗实行上市许可持有人制度,
持有人负有主体责任
根据《规定》,国家对疫苗实行上市许可持有人制度。持有人对疫苗的安全性、有效性和质量可控性负主体责任,依法依规开展疫苗上市后生产、流通等环节管理活动,并承担相应责任。
该部分重点强调了持有人对委托生产的疫苗负有主体责任,并且强调了疫苗生产从原辅料、包材供应商到疫苗供应过程中的储存、运输等相关主体将依法承担相应环节的责任,明确了疫苗全生命周期的责任要求,以及疫苗生产关键岗位如法定代表人/主要负责人、生产管理负责人、质量管理负责人、质量受权人以及负责疫苗流通质量管理的负责人的质量职责和资质要求,尤其强调相关人员应当具有良好的信用记录,药品严重失信人员不得担任相关职务。
此外,《规定》除了规定持有人应当定期对质量体系开展自查和持续改进外,还明确持有人应当按照规定对疫苗生产流通涉及的储存配送服务等供应商进行质量体系审核和监督,开展全过程质量风险管理等。笔者认为,这将对未来疫苗流通过程质量管理带来两个方面的影响,一方面持有人自身的疫苗全生命周期质量管理能力和水平要求提高,另一方面后续疫苗流通过程重的储存配送质量管理将更严格,尤其是仅接受疫苗委托运输的企业需要进一步加强运输质量管理水平提升。
二、疫苗生产管理严格准入,严控新开办疫
苗生产企业
新开办疫苗生产企业,除符合疫苗生产企业开办条件外,还应当符合国家疫苗行业主管部门的相关政策。
本部分重点强调持有人自身应当具备疫苗生产能力,并且明确生产许可申请流程。当然对国家相关管理部门提出储备需要,或疾病预防、控制急需的,并且认为持有人现有生产能力无法满足需求的,以及生产多联多价疫苗的持有人可提出疫苗委托生产申请。关于疫苗的委托生产管理要求也给予明确规定,比如:
委托方取得《疫苗委托生产批件》后,应按规定办理生产场地变更涉及的注册管理事项变更
委托方和受托方所在地省级药品监督管理部门应对两者开展药品生产质量管理规范符合性检查。
持有人应当建立完整的生产质量管理体系,生产过程中应当持续加强物料供应商管理、变更控制、偏差管理、产品质量回顾分析等工作。采用信息化手段如实记录生产、检验过程中形成的所有数据,确保生产全过程持续符合法定要求。
持有人因工艺升级、搬迁改造等原因停产,因设备故障等突发情况导致无法正常生产以及长期停产计划恢复生产的,均须在规定时限内向所在地省级药品监督管理部门报告,省级药品监督管理部门结合日常监管情况进行风险评估,必要时可对恢复生产的品种开展现场检查。
持有人在生产、流通管理过程中,发现可能会影响疫苗产品质量的重大偏差或重大质量问题的,应当立即向所在地省级药品监督管理部门报告。
三、疫苗流通管理:需具备疫苗冷链条件,
并负法律责任
该部分明确境外疫苗持有人原则上应当指定境内一家具备冷链药品质量保证能力的药品批发企业统一销售其同一品种疫苗,履行持有人在销售环节的义务,并承担责任。这一条一方面明确原则上指定境内1家药品批发企业销售,并且药品批发企业应该具备冷链药品质量保证能力。
另一方面明确持有人应当按照规定,建立真实、准确、完整的销售记录,如果是委托储存、运输的,还应当包括受托储存、运输企业信息(如受托储存、运输单位配送条件、配送能力及信息化追溯能力),并保存至疫苗有效期满后不少于5年备查。
在委托配送方面,该部分提出了更为明确和严格的要求,比如应向当地药品监督管理部门报告,应对配送企业的配送能力和储存、运输质量管理能力进行评估,限制委托配送数量,并且接受委托配送的企业不得再次委托。配送企业应按照国家疫苗全程电子追溯制度要求真实、完整地记录储存、运输环节信息等——
持有人委托配送要求:持有人可委托符合药品经营质量管理规范冷藏冷冻药品运输、储存条件的企业配送、区域仓储疫苗。持有人应当对疫苗配送企业的配送能力进行评估,严格控制配送企业数量,保证配送过程持续符合法定要求。持有人在同一省级行政区域内选取疫苗区域配送企业原则上不得超过2家。
疾病预防控制机构委托配送要求:疾病预防控制机构委托配送企业配送疫苗的,应当向同级药品监督管理部门和卫生健康主管部门报告。
四、严格疫苗变更管理
该部分明确了疫苗变更管理应当按照《药品注册管理办》的规定程序提出补充申请、备案或报告,并且明确持有人应当对相关变更开展评估、论证、研究和必要的验证,需要批准或者备案的,应当按程序经审核批准或者办理备案后方可实施。
五、疫苗监督管理实施分级管理,各级监督
管理部门的职责更明确
该部分明确国家药品监督管理局、省级药品监督管理部门、市/县承担药品监督管理职责的部门、药品监督管理部门依法设立或指定的专业技术机构等监督管理职责,特别明确省级药品监督管理部门承担本行政区域内疫苗生产流通活动的监督管理职责,对行政区域内接受委托生产和接受委托配送的受托方进行监督管理,以及疫苗上市后监督检查的方式、频次、检查程序、检查结果处理等要求,并且对疫苗召回管理、异常事件及出口管理作了相关规定描述。
最后,笔者附上《规定》的导图简版,感兴趣的朋友可以留言联系小编或作者索要完整电子版。

 027-85490452
027-85490452 027-85490452
027-85490452